-
一条通 8 家指定門市祭出半價優惠、10 款美食最低 20 元起!
2025-03-11 03:45 -
uuuu
2025-02-11 03:14 -
銷魂拌麵「剁椒魚頭」、創意甜點「花椒豆腐腦」必點!奇岩一號雙強主廚合推 10 款川湘風味菜單
2024-06-27 07:00 -
習近平的親俄路線徹底敗壞了中共的處境
2024-06-25 07:00 -
71歲的習近平為中國帶來什麼
2024-06-24 07:00 -
投書:從黃埔建軍到黃埔「遺毒」
2024-06-24 07:00 -
宋國誠專欄:怪哉,依法懲治「台獨」──中共的「自嗨政治學」
2024-06-24 07:00 -
普丁與金正恩親密駕車互動的「小心機」
2024-06-24 07:00 -
世界亂局中重建台灣能源安全:賴清德總統的抉擇
2024-06-24 07:00 -
投書:「核電是AI耗能的救星」 別扯了
2024-06-24 07:00
美國預計10月底給5-11歲小朋友打BNT疫苗 日程由臨床實驗決定
據美國衛生官員透露給《路透》的消息,政府預計在10月底讓5到11歲的兒童打BNT疫苗。開放日期仍取決於輝瑞/BioNTech公司,有臨床數據提供才能向美國食品藥物管理局(FDA)申請緊急使用授權。
消息之一源於美國免疫學家佛奇(Anthony Fauci)在國家衛生研究院(NIH)線上會議中,向數千名與會者提出的日程表。另一則消息來源也指出相似的日程表。
日程進度關鍵在臨床數據
數百萬名美國人引領期盼,尤其是家長們因為開學到來,擔心Delta變種病毒影響孩子的健康。目前期望FDA能在3周內完成疫苗對兒童的安全評估。
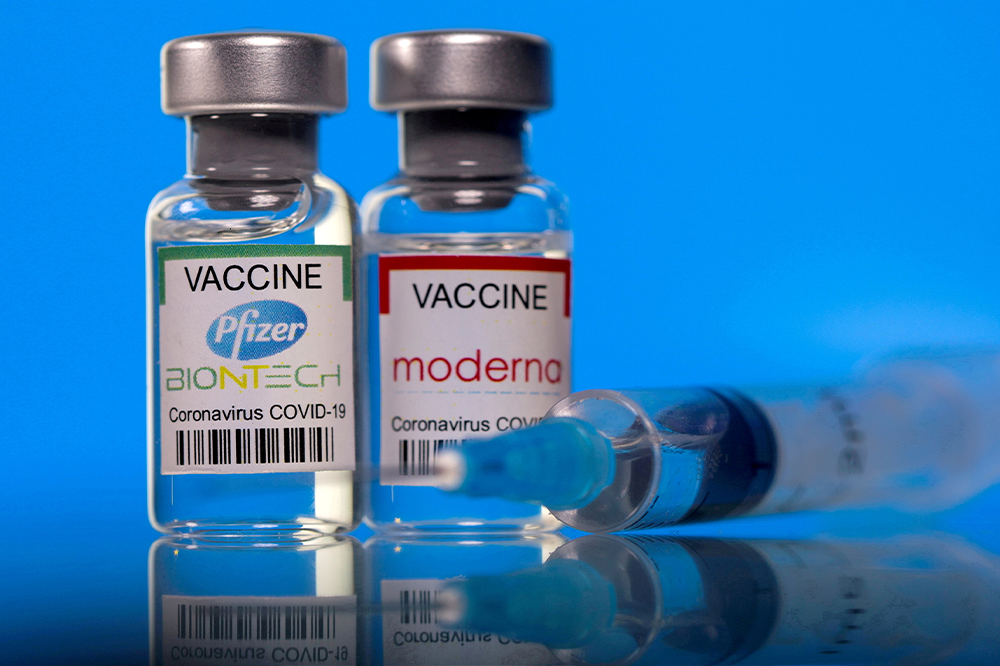
如果輝瑞在9月底提交緊急使用授權,而且它提供的數據也能佐證其功效,那麼就將如佛奇在會議中所言,「輝瑞可能將在10月的前幾周準備好」。
除了輝瑞,還有莫德納的也將提出授權使用,然而佛奇認為莫德納將花更長的時間去收集並分析5到11歲兒童的數據,估計開放該年齡層兒童接種莫德納的日程得等到11月。另外一則消息沒有明說,但卻表示「佛奇對莫德納的日程表有點太樂觀」。
關於這個會議的消息,輝瑞、莫德納與NIH沒有立即回應。不過輝瑞之前就曾表示,9月會準備好關於5到11歲兒童的數據,隨後申請緊急使用申請。莫德納則表示預計在年底完成對兒童施打的研究。
FDA通過程序期望縮減
申請不代表馬上就能開放,包括佛奇在內的衛生監管單位都表示,FDA的決定可能會遲至11月或更晚才做決定。

但據另一篇《路透》報導,測試兒童施打疫苗的臨床實驗必須經過至少兩個月的副作用觀察。FDA也表示,目前正在想辦法讓數據審核越快越好,希望能從幾個月縮減為幾周。
據FDA公布的疫苗研究到緊急使用授權路徑圖,疫苗製造商研製出的疫苗,臨床試驗前須先向FDA提出一次實驗申請,隨後才能進行3期臨床實驗。期間必須提交數據給FDA,FDA提供意見,再由製造商評估疫苗能否滿足FDA的預期,最後才會提出緊急使用申請。
製造商提出申請後,FDA將請專家評估該疫苗的各項數據,並召開諮詢委員會討論,確定疫苗的潛在利益大於風險,隨後通過緊急使用授權。
目前輝瑞已被授權用於12到15歲的美國兒童。另外2到5歲兒童的數據也即將準備好,6個月大到2歲嬰兒將在10月至11月取得安全性與免疫原始數據。

世代傳媒股份有限公司
信箱:service@upmedia.mg
電話:+886 (2) 2568-3356
傳真:+886 (2) 2568-3826
地址:新北市新店區寶橋路188號8樓
關於我們探索網站
地址:新北市新店區寶橋路188號8樓
電話:+886 (2) 2568-3356
傳真:+886 (2) 2568-3826
e-mail:service@upmedia.mg



 25.5°C
25.5°C







